-
Qu'est ce qu'une pile à combustible ?
Depuis longtemps je voulais faire un article sur les piles à combustible, mais c’est un sujet technique assez difficile et j’avais peur de ne pas l’expliquer de façon suffisamment simple.
Les schémas que je publie sont empruntés aux journaux “La Recherche” et “Pour la Science”..
Une “pile à combustible” désigne un appareil qui permet de récupérer de l’énergie électrique à partir de l’hydrogène.
On sait depuis longtemps récupérer de l'énergie à partir de ce gaz, mais c'est plus difficile de le faire industriellement de façon rentable et sure..
Le principe d'une pile à combustible, qui produit de l'électricité et de la chaleur en recombinant de l'hydrogène gazeux et de l'oxygène de l'air, en rejetant de l'eau, a été décrit dès 1806 par le chimiste britannique Humphry Dary, et le premier prototype remonte à 1839.
Aujourd’hui les piles à combustibles sont utilisées dans les navettes spatiales et ont montré leurs performances et leur fiabilité, mais au détriment de leur coût, qui est incompatible avec une utilisation domestique.
D’autre part, l'hydrogène n'existe pas à l'état naturel sur la terre. Utiliser un carburant implique de le produire, de le stocker et de ie distribuer à grande échelle, en toute sécurité et à bas prix. Il y a donc encore beaucoup à faire.
Pourquoi l'hydrogène ?
La molécule d’hydrogène gazeux H2, vous l’avez appris au lycée, est constituée de deux atomes d'hydrogène liés entre eux, et rompre cette liaison, par réaction avec I'oxygène de l'air O2, conduit à une importante libération d'énergie qui peut être convertie en électricité avec une pile à combustible. Cette réaction ne rejette que de l'eau (H2O).
L’hydrogène peut donc être envisagé comme une alternative non polluante aux énergies fossiles (pétrole, gaz naturel, charbon. ..).
Toutefois ce ne sera pas au niveau de “centrales”, mais au niveau plus local et individuel.
Cela peut aussi être une solution de stockage de l’énergie intermittente (éolienne, solaire) en produisant de l’hydrogène avec leur électricité, bien que ce processus risque d’être très onéreux (par multiplication de rendements < 1).
Qu’est ce qu’une pile à combustible ?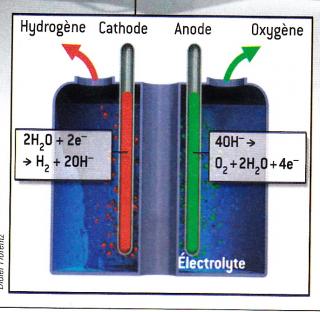
Vous connaissez sûrement pour l’avoir étudié au lycée, ce qu’est un “électrolyseur” et vous avez dû en utiliser en travaux pratiques.
Dans une cuve remplie d’un liquide très alcalin (par exemple de l’hydroxyde de potassium KOH), on plonge deux électrodes en nickel ou acier nickelé, que l’on appelle l’ “anode” (où se produit une oxydation avec production d’électrons), et la “cathode” (où se produit une réduction avec absorption d’électrons). Si on relie ces électrodes à un générateur électrique de quelques volts, (le pôle + à l’anode), on recueille de l’oxygène à l’anode et de l’hydrogène à la cathode (voir schéma ci-contre). Une pile à combustible est en quelque sorte l’inverse d’un électrolyseur.
Une pile à combustible est en quelque sorte l’inverse d’un électrolyseur.
Les réactions chimiques sont les mêmes que dans l’électrolyseur, mais inversées (voir schéma ci contre).
L’hydrogène traverse un diffuseur - une matière carbonée poreuse - et atteint l'anode de la pile où il est dissocié en deux protons H+ et deux électrons.
Les électrons circulent dans les circuits électriques des utilisateurs et reviennent vers la cathode.
Les protons produits à l’anode traversent une membrane en polymère et sont attirés par la cathode, où ils se combinent à des électrons libérés par cette électrode et à de l’oxygène, reformant de l'eau.
Les électrodes, l’anode et la cathode sont constituées de fines particules - des nanotubes de carbone ou des grains de noir de carbone de 50 nanomètres de diamètre sur lesquelles est déposé un catalyseur qui facilite la recombinaison H2 / O2. Actuellement ce catalyseur est constitué de fines particules de platine de quelques nanomètres de diamètre, ce qui est extrêmemnt onéreux.
On espère pouvoir remplacer le platine par des molécules organiques imitant le site actif d'enzymes qui libèrent de l'hydrogène chez des bactéries, et produire ainsi un catalyseur bon marché. Les diffuseurs que l’on voit sur le schéma sont destinés à bien répartir oxygène et hydrogène sur les électrodes. Un catalyseur mélange de fer et de produits carbonés a aussi été expérimenté ainsi que des mélanges de métaux avec du graphème sous forme de nanotubes de carbone. Des nanoparticules d'un mélange nickel, molybdène, 1000 fois moins cher que le platine est aussi en cours d'étude.
Une solution plus originale et plus prometteuse au plan des coûts est à l’étude notamment au Laboratoire des Métaux du CEA à Grenoble.
Certains micro-organismes ont élaboré des systèmes enzimatiques efficaces pour catalyser les réactions qui ont lieu Ies électrolyseurs ou les piles à combustibles et n'utilisent que des métaux abondants. Par exemple, pour réduire l'eau en hydrogène, les hydrogénases présentes de nombreuses bactéries ou micro-algues utilisent du nickel ou du fer.
Les chimistes essaient de reproduire les propriétés des sites actifs de ces enzymes.
 Un autre problème concerne le stockage de l’hydrogène, trop dangereux à l’état gazeux.
Un autre problème concerne le stockage de l’hydrogène, trop dangereux à l’état gazeux.
Sous forme gazeuse, l’hydrogène, très léger occupe un grand volume et il faut donc le mettre sous très haute pression dans des réservoirs d’aciers, lourds et encombrants. De plus les fuites sont possibles et au contact de l’oxygène de l’air, la moindre étincelle ou flamme produit l’explosion.
Il faut donc trouver d’autres moyens de stockage.
L’hydrogène peut être stocké sous forme solide dans des structures métalliques. Quand on abaisse la température, les molécules d'hydrogène réagissent avec le métal, se dissocient et s'insèrent dans la structure pour former un hydrure métallique. Quand on remonte la température, le gaz d'hydrogène se reconstitue. Le métal est entouré d'un « tampon » qui stocke la chaleur
dégagée pendant le stockage et la restitue lors du déstockage. Un conteneur de la taille d'un gros cumulus domestique contient 4,5 kilogrammes d'hydrogène, ce qui suffirait pour couvrir les besoins d'une famille française durant plus d'une semaine. (cf. schéma ci contre).
Demain je vous donnerai quelques explications sur les possibilités réelles de cette filière.
-
Commentaires

